- Point1
統一書式(書式3、4、5、参考書式1)の効率的な作成支援
※治験情報や委員情報の自動挿入、
書式間の情報の引継ぎなどが行えます - Point2
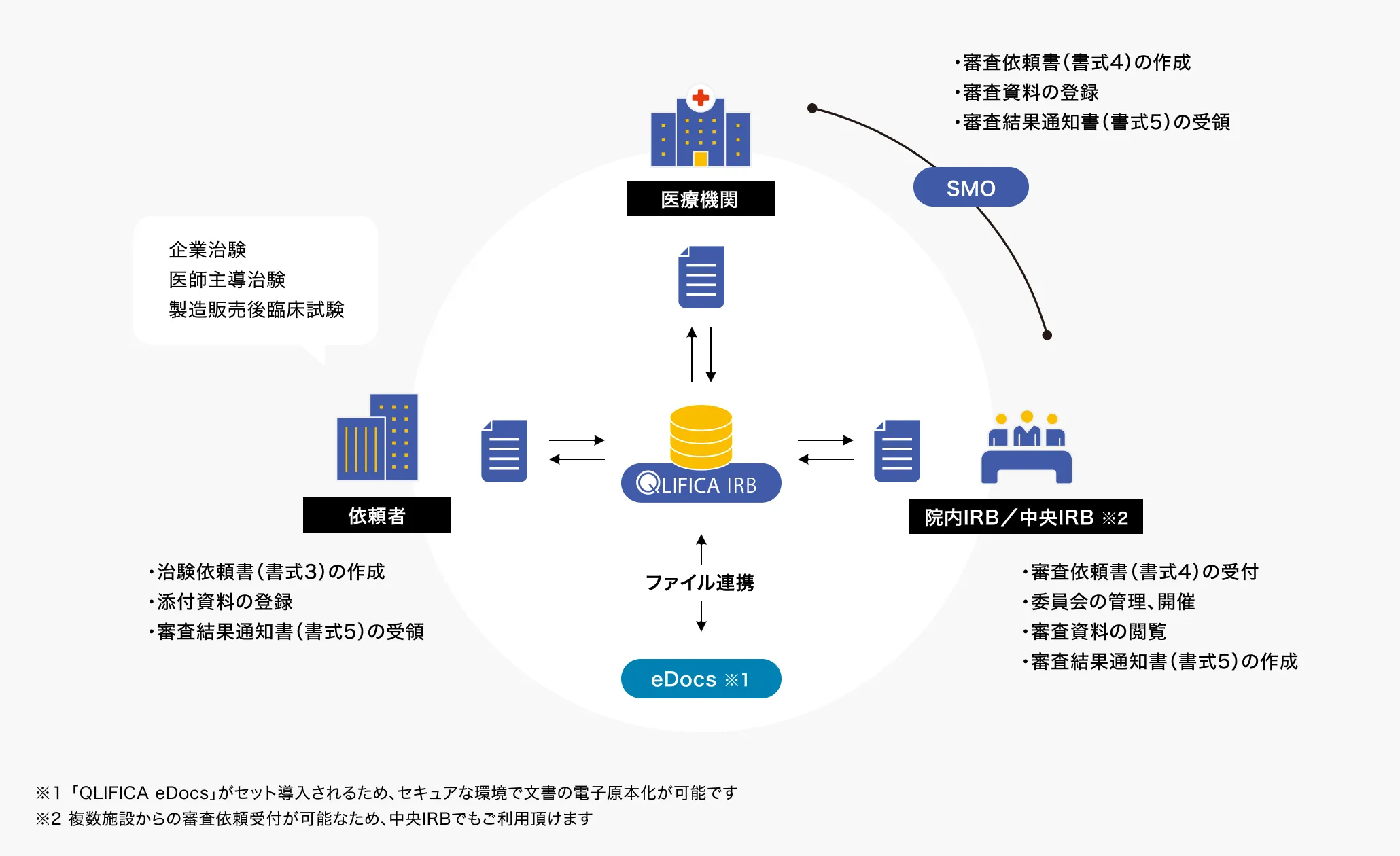
IRB、医療機関、依頼者の
各立場で共同利用 - Point3
IRB会議の招集から
開催までを支援 - Point4
審査依頼や結果通知、
開催案内などをメールで通知 - Point5
ER/ES指針に対応した
電子原本管理 - Point6
高セキュリティ環境での
文書の保管・閲覧
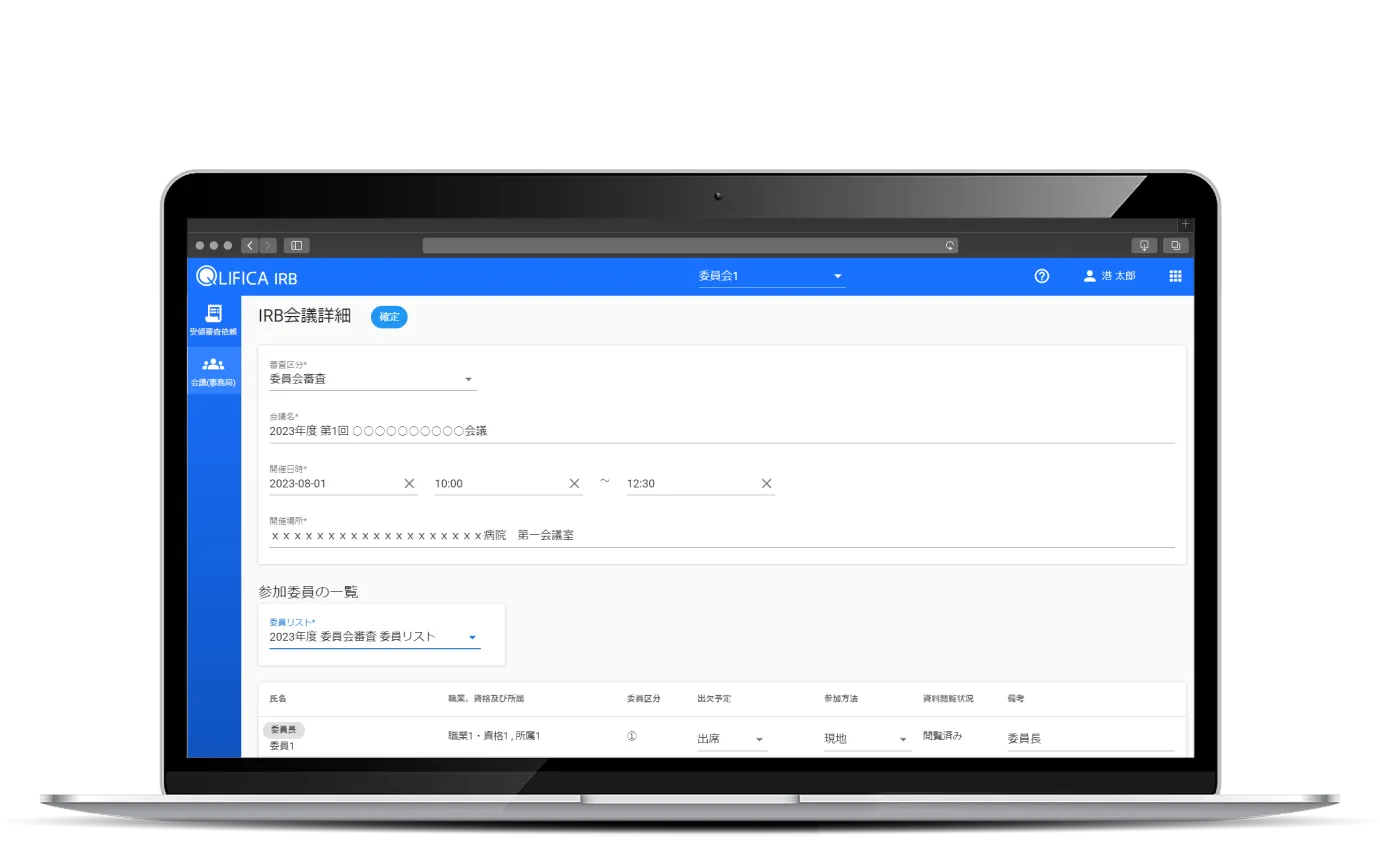
統一書式の作成
共通項目の「審査事項」を引き継いで書式3、4、5の作成が可能、
指示決定通知において参考書式1の作成も行えます。
入力誤りや記載漏れを防ぎ、書式作成・チェックの負担を削減、
作成完了後には相手先に通知できます。
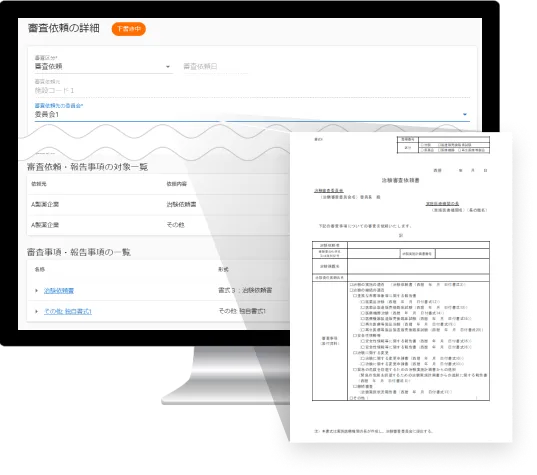
IRB資料のペーパーレス化
IRB資料は、委員がシステムにアクセスすれば資料を閲覧できるため、
事前の紙配布が不要です。ペーパーレス化を実現し、
印刷・配送・廃棄コスト、作業人件費を削減できます。
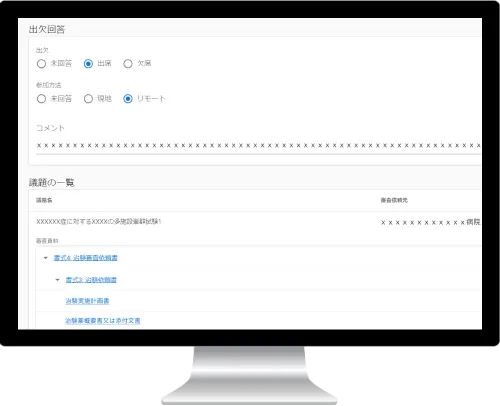
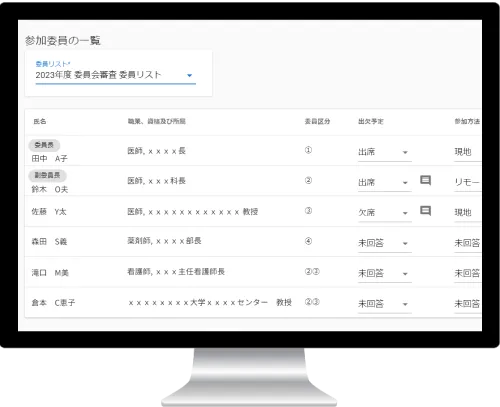
参加委員の管理
委員が入力した出欠予定や参加方法、
資料の閲覧状況などが一覧で確認できます。
必要に応じ委員にリマインドを送ることも可能です。
※スクロールしてご覧ください
| 機能 | 内容 |
|---|---|
| 委員会の管理 | 委員会の概要や構成する委員の管理 |
| 治験情報の管理 | 企業治験や医師主導治験などに対応した治験情報の管理 |
| 治験の依頼 | 治験依頼書(書式3)の作成(添付資料のアップロード含む) |
| 治験審査の依頼 | 治験審査依頼書(書式4)の作成(審査資料のアップロードを含む)、IRBへの提出 |
| IRB会議の準備 | IRB会議の開催情報・委員の出欠回答の管理、治験審査依頼書(書式4)の議題化 |
| IRB資料の閲覧 | 委員によるIRB資料の閲覧・ダウンロード、閲覧状況の確認 |
| IRB会議の開催 | 議題毎の審査結果・議事の登録 |
| 治験審査結果の通知 | 治験審査結果通知書(書式5)の作成、依頼者・医療機関への提出 |
| 指示決定 | 依頼者への指示決定(書式5または参考書式1)の提出 |
| その他文書の保管 | 上記以外の文書を自由なフォルダー構成で保管 |
| メール通知 | 審査依頼や結果通知、開催案内など |
QLIFICA共通機能
| 機能 | 内容 |
|---|---|
| 試験情報の管理 | 試験、施設、被験者の登録・編集 / 担当者の指名 |
| 監査証跡の記録 | システム利用上の監査証跡を自動的に記録 |
| ER/ES指針への準拠 | ER/ES指針に準拠 |
| 利用者情報の管理 | 利用者の登録や利用停止/再開などを管理 |
| 担当者の権限設定 | 試験の実施体制に応じた柔軟な権限設定 |







